実験室での研究活動紹介
私達の研究室はウイルス性疾患を対象とした基礎研究を実施しています。
研究室には病理学を学んできた者が多いので、細胞組織及び免疫組織学的方法を得意としており、更に分子生物学的手法、ウイルス学的実験手法等を駆使して、種々の実験を推進しています。
研究の柱は、1)ウイルス感染による宿主の病態の解析、2)ウイルスの細胞内動態の解析、3)ウイルス感染症に対する治療法の開発の3つです。
以下に実際に私達が現在推進している研究を紹介します。
アルボウイルス感染症の病態解析
蚊やマダニなどの節足動物が媒介し、ヒトや動物に病気を起こすウイルス(総称してアルボウイルス)において、ヒトでの病態を模倣するウイルス感染動物モデルを構築し、ウイルスの体内での感染増殖メカニズムと、感染による宿主反応ネットワークを明らかにしします。現在は健常マウスでのモデルが確立されている日本脳炎ウイルス、ウエストナイルウイルスなど脳炎を起こすフラビウイルスを中心に研究を実施しています。ウイルス学、免疫、イメージング、数理などの分野の研究者との共同研究により、重症化の予測・予防に繋がるバイオマーカーの同定、感染による宿主応答パタンと病原性発現の関連性を明らかにして、ウイルス-宿主相互作用感染ネットワークの数理モデルの構築に繋がるデータを蓄積します。
この研究は、ムーンショット型研究開発事業 目標2:2050年までに、超早期に疾患の予測・予防をすることができる社会を実現「ウイルス-人体相互作用ネットワークの理解と制御」のプロジェクトとして実施しています。
https://ms-virus.biken.osaka-u.ac.jp/research/virus/yasuko_orba
プロジェクトで作っていただいた研究図解はこちら
https://ms-virus.biken.osaka-u.ac.jp/tsunagarilab/articles/20230714
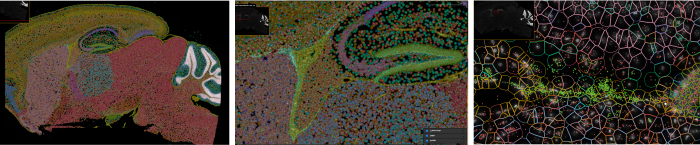
日本脳炎ウイルス感染マウス脳のXenium in situによる空間的遺伝子発現解析
日本脳炎、ウエストナイル熱、デング熱、ジカ熱などの蚊媒介性感染症では、節足動物に刺された際に、唾液等と共にウイルスが皮内に入ることで感染が起こります。この時皮膚で起こる様々な反応がウイルスの増殖に影響することから、刺咬による感染経路を反映したモデルを構築しています。また、ヒトスジシマカやネッタイシマカなどの継代飼育蚊を用いて、厳重な逃亡防止策のもとでウイルス感染実験を行い、伝播に関わる蚊でのウイルス増殖機構の解析や、蚊の唾液成分が感染に及ぼす影響についても研究しています。

節足動物飼育室のグローブボックス内での蚊を用いた実験
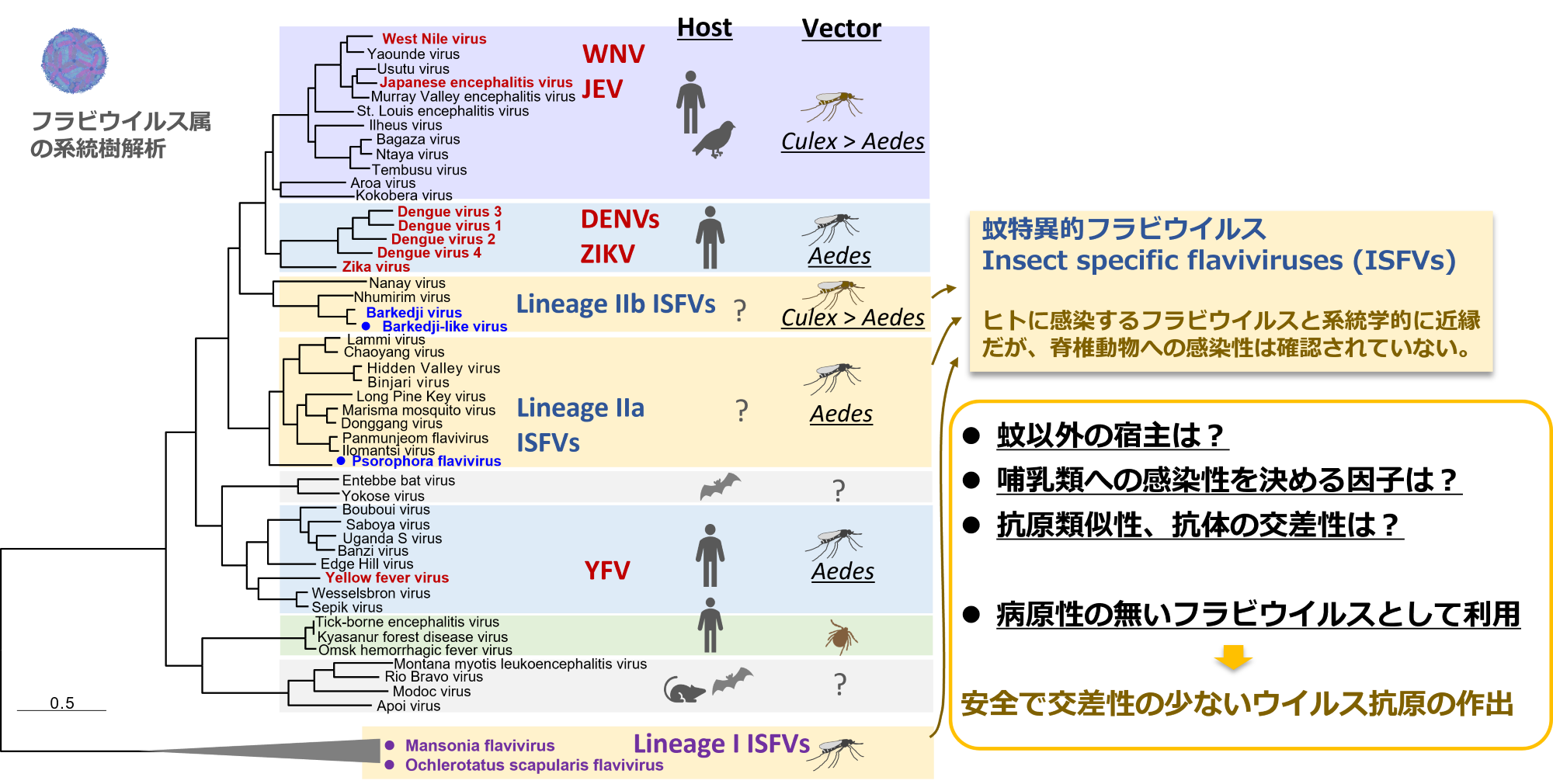
蚊特異的フラビウイルスの研究
これまでに各地の野外生息蚊から、新規ウイルスを含めた多くのウイルスを発見しています。これらのウイルスの多くは、ヒトや哺乳類動物に感染しない(我々にとっては病原性の無い)ウイルスと考えられます。ウイルスの進化的にも興味深いですし、電子顕微鏡で見るととても面白い形状をしているウイルスもいます。そんなウイルスたちの生活環の解明や、役割なども明らかにしたいところですが、、人獣共通感染症を研究する研究所ですので、まずは感染症克服に役立てる方法を考えています。
蚊特異的なフラビウイルスは、デングやジカウイルスなどの脊椎動物感染性フラビウイルスと系統学的に近縁ですが、哺乳類動物細胞に感染しません。このことから、哺乳類動物に感染するために必要なウイルスの宿主規定領域および宿主側の規定要因を明らかにするため、これらのキメラウイルスなどを作出して研究しています。
フラビウイルス属はウイルス種間の抗原類似性が高いため、抗体検査での交差反応が問題となります。またこの交差反応は、ワクチン開発においても大きな障壁となっています。我々の研究では、ヒトへの感染性が無い蚊特異的フラビウイルスを用いた抗体検査法やワクチン抗原の開発を試みています。デングやジカウイルスなどの構造タンパク質上で交差反応を引き起こす主要なエピトープを、蚊特異的フラビウイルスの配列に置換することで、ウイルスタンパク質構造を保ちつつも、交差反応を軽減した、フラビウイルス種特異的な抗原の開発を試みています。
狂犬病ウイルスの細胞感染機構の解析
狂犬病は毎年世界で5,5000人以上の人を死に至らしめる人獣共通感染症です。狂犬病の原因ウイルスである狂犬病ウイルス(RABV)は、全ての哺乳類動物に感染し、狂犬病罹患動物による咬傷から人の体内に侵入し、中枢神経系に到達すると致死的な神経症状を惹起します。
私達は、狂犬病ウイルスの増殖機構の解明を目指して、狂犬病ウイルス増殖に利用される、もしくはウイルスの増殖を抑制する宿主因子を探索しています。更に、ウイルスがコードするタンパク質と宿主因子の相互作用について研究しています。
これまでに、細胞の表面に存在するヘパラン硫酸が狂犬病ウイルス粒子と結合し、ウイルスの効率的な細胞吸着を促進することでウイルス感染を増大させることを見出しました。さらに、ウイルスのGタンパク質がリガンドとして機能すること、ヘパラン硫酸のN型-硫酸修飾が狂犬病ウイルスとの結合に重要であることを示し、狂犬病ウイルスとヘパラン硫酸の結合機構の詳細を明らかにしました(Sasaki et al, J Infect Dis., 2018)。
また、岐阜大学応用生物科学部の杉山博士、伊藤博士との共同研究で、reverse geneticsを利用した組換えRABVを作出しました(Anindita et al, Virus Res., 2016)。作出した組換えRABVを用いて、化合物のスクリーニングを実施し、狂犬病ウイルス増殖を阻害する化合物を見出しました(Anindita et al, Antiviral Res., 2018)。
ウイルス性疾患の制圧に向けた治療法の開発研究
私達は、塩野義製薬とデング熱を主としたウイルス性疾患に対する治療法の開発についての共同研究を実施しています。
デング熱はシマカ(ネッタイシマカ、ヒトスジシマカ)によって媒介されヒト-ヒトの間で感染環が成立しているフラビウイルス科に属するデングウイルス(DENV)によって惹起される感染症です。DENVは血清型により4種類(DENV-1, DENV-2, DENV-3, DENV-4)に分類されます。2014年に東京の代々木公園を中心として発生したデング熱はDENV-1によるものだったと報告されています。デング熱は熱帯、亜熱帯に存在するアジア、アメリカ、アフリカの100カ国以上で発生しており、世界中で10億人が感染の危険に晒されているという報告があります。DENVに感染した症例はウイルス血症を呈することにより、次の感染者に対するウイルスの補給源となります。DENVに感染すると20-50%の方は一過性の発熱を伴うデング熱を発症し、1週間ほどで治癒します。初感染後、他の血清型のDENVに感染すると血漿の漏出と出血傾向を伴うデング出血熱(Severe Dengue)を発症する確率が増加します。
現在DENVによる感染症に対しての予防法、及び治療法は確立されておらず、私共は共同研究として治療薬の開発を試みております。更に、他の新興・再興感染症についても共同研究を展開しています。
[シオノギ抗ウイルス薬研究部門の紹介はこちら]

