Fieldにおける疫学研究活動紹介
COVID-19、豚由来H1N1パンデミックインフルエンザウイルス感染症、エボラウイルス病、ヘニパウイルス感染症、中東呼吸器症候群、重症熱性血小板減少症候群、狂犬病に代表される新興・再興感染症の多くは、自然宿主である動物内で維持されていた病原体が、ヒトに伝播した際に重篤な病態を引き起こす人獣共通感染症です。従って、将来発生する新たな人獣共通感染症への備えとして、動物が保有する病原体に関する知見を蓄積することが感染症の先回り対策として重要です。私達はザンビア共和国やインドネシア共和国に生息する野生動物を中心に様々な地域で現地の共同研究者と共に、ウイルス探索、血清学的解析を実施しています。
ザンビアはアフリカの南部中央に位置しており、面積は日本の約2倍(75.2万平方km)、人口は日本の約1/10(1347万人)です。ザンビア共和国には73の部族が共存していますが、内政は独立以来安定しています。主な産業はトウモロコシ等を主とする農業、銅鉱業、観光等です。首都のルサカに最大規模のザンビア大学があり、学生数は約1万人です。
北海道大学獣医学部とザンビア大学獣医学部の交流は、日本の無償資金協力により、獣医学部が設立された1985年から継続しており、今年で30年を迎えます。新興・再興感染症研究拠点形成プログラムにより、ザンビア大学獣医学部にP2及びP3実験室を設置し、2008年8月に北海道大学人獣共通感染症リサーチセンターザンビア拠点を設置しました。その後本拠点を活用して様々な活動を実施してきました。
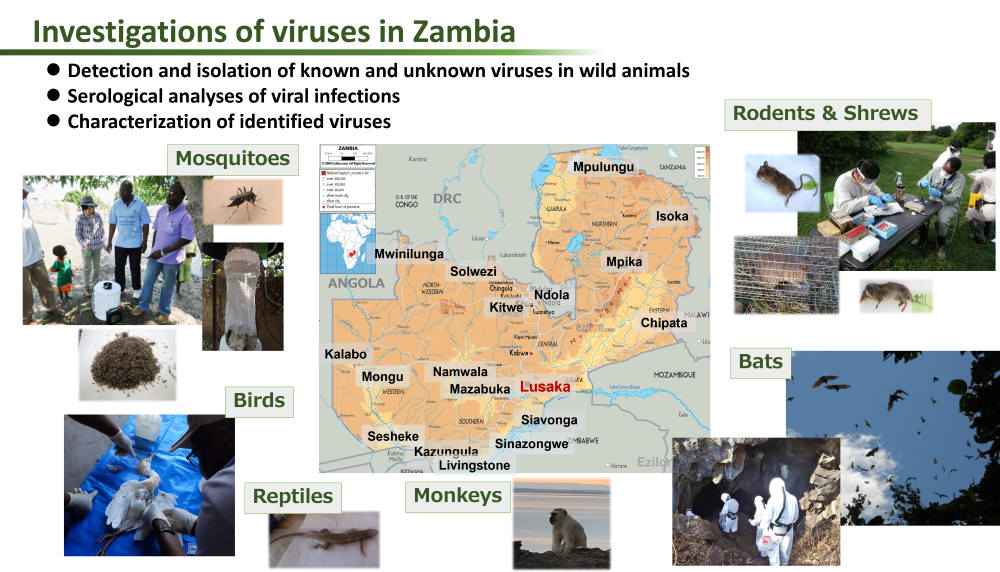
これまでに野生動物から様々なウイルスを同定、単離しています。病原体を広範囲に検出するPCRアッセイ系の開発や、次世代シークエンサーによるメタゲノム解析により網羅的にウイルスを検出し、新規のウイルスも含めて多くのウイルスを同定しています。ウイルスの病原性を明らかにするには、ウイルスを分離する必要があることから、効率的なウイルス単離方法も日々検討しています。また血清学的調査によりウイルス感染症の流行状況を調査し報告しています。
・げっ歯類動物やトガリネズミ
Polyomavirus Orba Y, J Gen Virol. 2011.
Orthopoxvirus Orba Y, J Gen Virol. 2015
Paramyxoviruses Sasaki M, J Gen Virol. 2014
Bufaviruses Sasaki M, Emerg Infect Dis. 2015
Orthoreovirus Harima H, J Vet Med Sci. 2020
Encephalomyocarditis virus Kishimoto M, J Gen Virol. 2021
Rotavirus A Kishimoto M, J Virol. 2023
・コウモリ
Paramyxoviruses Muleya W, J Vet Med Sci. 2014
Nairovirus Ishii A, Nat Commun. 2014
Bufaviruses Sasaki M, Sci Rep. 2016
Rotavirus Sasaki M, J Gen Virol. 2016
Polyomavirus Carr M, J Gen Virol. 2017a, 2017b
Marburgvirus Kajihara M, Emerg Infect Dis. 2019
Orthoreovirus Harima H, PLoS Negl Trop Dis. 2021
Rotavirus A Kishimoto M, J Virol. 2023
・霊長類動物
Polyomavirus Yamaguchi H, J Gen Virol. 2013
Human parainfluenza virus Sasaki M, Emerg Infect Dis. 2013
Bufaviruses Sasaki M, Emerg Infect Dis. 2015
Orthopoxvirus Orba Y, J Gen Virol. 2015
Simian immunodeficiency virus Carr M, Arch Virol. 2016
Smacoviruses Anindita PD, Sci Rep. 2019
Zika virus Wastika CE, Arch Virol. 2019
・蚊
West Nile virus Orba Y, Transbound Emerg Dis. 2018
Mwinilunga alphavirus Torii S, Virus Res. 2018
Barkedji virus, Barkedji-like virus Wastika CE, Viruses. 2020
Rift Valley fever virus Chambaro HM, PLoS Negl Trop Dis. 2022
Bunyaviruses Orba Y, Sci Rep. 2023
・ワニ
West Nile virus Simulundu E, Emerg Infect Dis. 2020
次世代シーケンサーを用いた網羅的ウイルス探索
モグラ、ジネズミに代表される食虫動物は人の居住環境周辺に生息しています。その遺伝的背景や食性は齧歯動物のものとは大きく異なるため、保有する病原体も齧歯動物のものとは異なることが予想されますが、食虫動物が保有するウイルスに関する知見はほとんどありません。次世代シークエンサーを用いたジネズミ糞便のメタゲノム解析を実施し、糞便中に存在するウイルスについて網羅的に検索しました。その結果、ヒトの急性腸炎や原因不明神経疾患の患者便から検出されたウイルスに近縁な新規サーコウイルス、ピコルナウイルス、パルボウイルスが見出され、ジネズミが人獣共通感染症を引き起こす病原体の潜在的な宿主であることを明らかにしました(Sasaki et al. J. Gen. Virol., 2015)。検出した新規パルボウイルスは、2012年にヒトの下痢症患者から発見された新規パルボウイルスBufavirusによく似たウイルスでした。私たちはザンビアに生息する霊長類動物、インドネシアに生息するコウモリからも類似のウイルスを検出し、自然界における動物bufavirusの存在を初めて明らかにしました(Sasaki M. et al. Emerg Infect Dis, 2015)(Sasaki M. et al. Sci Rep, 2016)。

